12月12日,Mirati Therapeutics宣布美国FDA已加速批准Krazati™(adagrasib),一种针对KRAS G12C突变局部晚期或转移性非小细胞肺癌(NSCLC)成年患者的靶向治疗方案,通过FDA批准的测试确定。
该试验显示ORR为43%(95% CI:34-53),80%(95% CI:71-87)的患者实现了疾病控制。平均DOR为8.5个月(95% CI:6.2-13.8)。
FDA的批准是基于adagrasib在支持注册的2期临床试验KRYSTAL-1中的队列结果。在携带KRAS G12C突变的晚期NSCLC患者中,adagrasib达到43%的客观缓解率(ORR)和80%的疾病控制率(DCR)。值得一提的是,98.3%的患者曾经接受过化疗和免疫疗法的治疗。
Mirati公司宣布,adagrasib与PD-1抑制剂pembrolizumab联用,在一线治疗携带KRAS G12C突变的NSCLC患者的早期临床试验中表现出良好的安全性。它与EGFR抑制剂cetuximab联用,在治疗结直肠癌患者时也表现出良好的效果。期待这款KRAS抑制剂能够造福更多癌症患者。
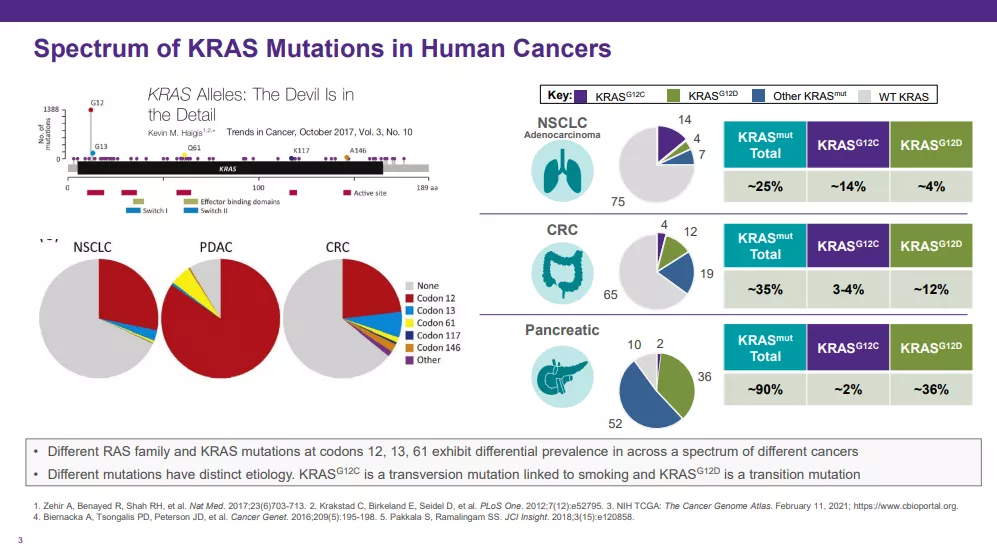
作为人类癌症中最常见的突变致癌基因之一,KRAS是多种癌症类型的驱动因子。约25%的人类癌症发生KRAS突变,KRAS突变在一些最常见和致命的癌症(包括90%以上的胰腺癌和肺癌)中起了重要作用。
sotorasib是第一个进入临床开发的KRAS G12C抑制剂,于2021年5月获得美国FDA批准(商品名为Lumakras),用于治疗先前已接受过至少一种系统疗法、经FDA批准的检测方法证实存在KRAS G12C突变、局部晚期或转移性NSCLC成人患者。在临床试验中,sotorasib治疗显示出快速、深度、持久的抗癌活性,具有积极的益处-风险特征。
在中国,sotorasib于今年2月被国家药品监督管理局(NMPA)药品审评中心(CDE)纳入“突破性治疗药物”。这一认定是针对其用于治疗既往接受过至少一种系统性治疗的、携带KRAS G12C突变的局部晚期或转移性NSCLC患者。
每日口服一次960mg Lumakras治疗的患者,客观缓解率(ORR)为37.1%(95%CI:28.6-46.2),中位缓解持续时间(DoR)为11.1个月,疾病控制率(DCR)为80.6%,中位总生存期(mOS)为12.5个月。
